放射線とは何か? 原子と同位体

Related Articles
福島第一原発の問題を受け、ニュースは、同位体、放射線、汚染、そして健康被害などの話であふれ返っています。しかし、「半減期」や「マイクロシーベルト」と言われても、よくわかりませんよね。今話題になっている一連のニュースを理解するためには、原子物理学について少し知っておく必要があります。これからの連載記事では、最近の話題をより理解するために、いくつかのポイントとなる概念について紹介していきます。(「物理なんてわからない」と心配するには及びません。全部、簡単にまとめてありますよ。)
まずは一番基本的な、原子の話から始めましょう。
原子の構造
恐らく、皆さんは原子の構造については、ある程度のイメージがあるのではないでしょうか。
原子の中心には「陽子」と「中性子」とからなる「核」があります。核の周りは、電子が雲のように覆っています。陽子はプラスの電気を帯び、中性子は電気を帯びておらず、電子はマイナスの電気を帯びています。各要素が持つこの電気的性質によって、電子は核の周りにまとまっています。また、陽子と中性子は核力という別の力によってまとまっています。
核内にある陽子の数は、その原子がどのようなものであるか、つまり、それがどの「元素」のものであるか、ということを決めています。もし陽子が1個であればその原子は水素、陽子が6個であれば炭素、という具合です。ウラニウムになると陽子が92個になり、とても大きな原子になります。
電気的に中性な原子、つまりはプラスの電気もマイナスの電気も帯びていない原子は、陽子の数と電子の数が同じです。なので、電気的に中性な水素は1個の電子を持っていますし、電気的に中性な炭素は6個の電子を持っています。しかし、原子はいつも電気的に中性とは限らず、電子の数は陽子の数と等しくない場合があります。これは、化学反応の上では重要なことですが、とりあえず放射線を語るには必要ないので、横に置いておきましょう。
同位体は同じ元素だけど中性子の数が違う
大事なことは、同じ元素でも違う数の中性子を持っている場合がある、ということです。同じ元素で、このような違いを持つ原子を同位体と呼びます。
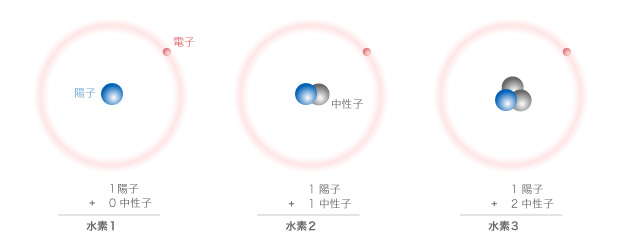
例えば、一番普通に見られる水素(水素1)は、1個の陽子と1個の電子を持っています。しかし、水素2と呼ばれる同位体は、1個の陽子と1個の中性子と1個の電子を持っています。そして、水素3は1個の陽子と2個の中性子と1個の電子を持っています。異なる同位体に割り振られた数字は、陽子と中性子の和によって決まっています(例えば水素3では、陽子1個+中性子2個なので水素3、となっています)。
もう一例を炭素でみてみましょう。炭素は6個の陽子を持っていて、これが炭素原子を炭素たらしめています。一般的な炭素原子は、中性子が6個あります。この炭素は、炭素12と呼ばれています。同位体である炭素13は7個の中性子を持ち、炭素14は8個の中性子を持っています。しかし、どれも炭素なので、全て共通して6個の陽子を持っています。
崩壊とは違う元素に変わること
同じように、ほとんどの元素はいくつかの同位体を持っています。そのうちの多くは、陽子と中性子と電子の間に働く力のバランスが崩れているため、とても不安定な状態にあります。つまり、不安定な同位体はそのままでの状態であることを嫌がり、もっと安定したものになりたがる、ということです。その結果、全く違う元素に変化してしまうことが度々あります。この変化を「崩壊」といい、この過程で、同位体は余分なエネルギーを放射線として放出します。
このように、多くの同位体は放射性(崩壊して別の元素に変わる際に放射線を出すこと)を持っています。このような、不安定で放射線を出す同位体を、「放射性同位体」といいます。
次回は、「半減期」とはどういうものかみていきましょう。